![]()
Il calorimetro è l’apparecchio adatto a determinare la quantità di calore ceduta o assorbita da un corpo posto in contatto termico con un altro , tramite la misura di effetti prodotti in quest’ultimo
dalla quantità di calore scambiata ( esempio liquefazione o formazione di una certa quantità di ghiaccio ,variazione di temperatura , aumento o diminuzione di una resistenza elettrica ).
I calorimetri possono essere divisi in due grandi categorie: quelli nei quali sono essenziali le misure di temperatura e quelli il cui funzionamento si basa sulla conoscenza del calore latente in gioco in un determinato cambiamento di stato.
PRIMA CATEGORIA:
Con i calorimetri di tale categoria è possibile è misurare la capacità termica di un corpo, somministrando una quantità nota di calore e misurando l’innalzamento di temperatura; viceversa, nota la capacità termica, è possibile determinare la potenza dissipata da una certa sorgente di calore.
calorimetro ad acqua o delle mescolanze è formato da un vaso calorimetrico, termicamente isolato , contenente un liquido noto ( di solito acqua), in cui sono immersi un termometro assai sensibile e un agitatore. Con questo dispositivo si possono misurare delle quantità di calore: sia C la capacità termica del liquido, del vaso calorimetrico, del termometro e dell’agitatore, X una quantità incognita di calore somministrata in modo qualsiasi al calorimetro, Δt il corrispondente salto di temperatura, si ha: X = C Δt.
SECONDA CATEGORIA:
Nei calorimetri della seconda categoria non sono necessarie misure di temperatura: dei due sistemi che si scambiano calore almeno uno è a temperatura costante ( quello in cui è in atto un cambiamento di stato).
calorimetro di Lavoisier è un calorimetro a cambiamento di stato: nell’interno di un termostato a ghiaccio fondente è contenuto un recipiente anch’esso pieno di ghiaccio. Se all’interno del recipiente viene sviluppata una certa quantità Q di calore, una massa m di acqua passerà dallo stato solido allo stato liquido secondo la relazione Q = mλ, dove λ è il calore latente di fusione, che per l’acqua vale 79,4 cal\g. questo calorimetro non è più usato per la sua scarsa precisione.

calorimetro di Bunsen è dello stesso tipo del precedente, con la differenza che la quantità di acqua che si scioglie viene misurata sfruttando la diversità di calore specifico fra acqua e ghiaccio, che è del 9,07 % e che può facilmente essere determinata con grande precisione, dato che il fenomeno avviene a temperatura costante e tutti i recipienti non variano il loro volume. L’apparecchio è costituito da una provetta P saldata ad un recipiente R, riempito in uno dei suoi bracci da acqua e mercurio, e nell’altro braccio da solo mercurio, che termina con un sottile capillare calibrato. Il tutto è contenuto in un termostato ed è mantenuto alla temperatura del ghiaccio fondente. Per eseguire una misura si introduce nella provetta una miscela frigorifera, facendo così formare una crosta di ghiaccio sulla parete esterna. Tolta la miscela, si lascia che l’apparecchio si ponga in equilibrio e si misura il punto in cui si è formato il mercurio nel capillare; si sviluppa, quindi, all’interno della provetta la quantità di calore da misurare e si osserva lo spostamento del mercurio nel capillare.

Il calorimetro di Bunsen; a) ghiaccio fondente; b) miscela frigorifera; c) mercurio
calorimetro elettrico è molto adatto alla misura di calori specifici. È costituito da un recipiente vuoto in cui un blocco di massa della sostanza in esame viene tenuto sospeso da due fili, che conducono la corrente elettrica in una spiralina di platino, contenuta nel blocco stasso. Se la corrente viene fatta passare nella spirale per un tempo Δt, essa sviluppa una certa quantità di calore. Questo apparecchio permette misure di grande precisione.
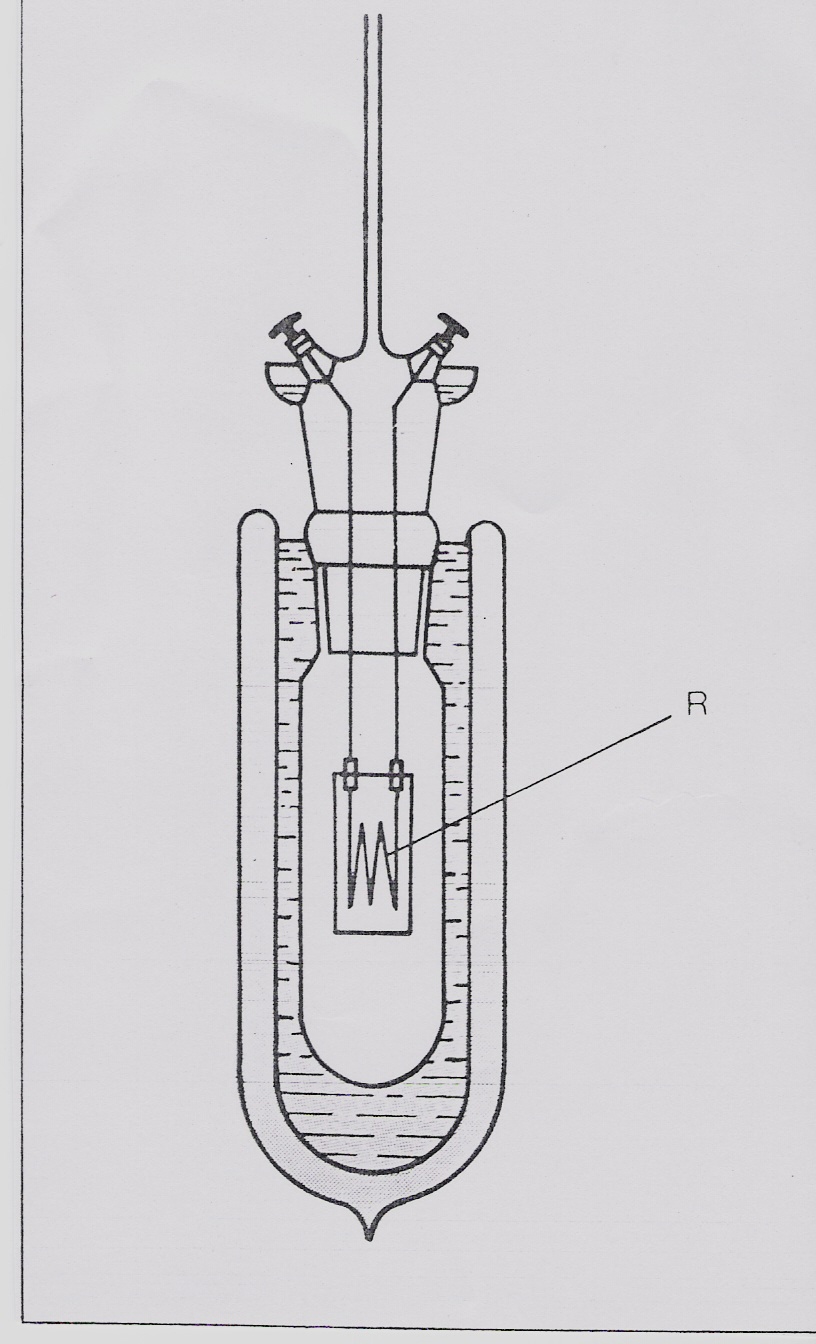
Calorimetro elettrico: R resistenza elettrica annegata nel blocco del campione.
Per la misura di piccole quantità di calore si usano speciali calorimetri, chiamati microcalorimetri ;tra questi sono particolarmente importanti e diffusi dispositivi che sfruttano l’effetto joule ed il fenomeno per cui la resistenza elettrica di un conduttore varia con la temperatura .
Per la misura del potere calorifico dei combustibili si usano le cosiddette bombe calorimetriche , camere di acciaio entro le quali si fa bruciare elettricamente il combustibile liquido o solido in esame. Il calore prodotto è misurato dall’aumento della temperatura di una massa di acqua in contatto termico con le camere suddette.
